为什么要定义焓?
为了使用方便。因为在等压、不作非膨胀功的条件下,焓变等于等压热效应Qp,Qp容易测定,从而可求其它热力学函数的变化值。
化学反应过程中的热量变化有些可以由实验测得,但有些反应由于自身反应特点等原因很难测量,但可以根据一些相关数据而间接得到。
下面我们先看几个关于焓的定义:
4.1.6.1盖斯(Hess)定律
定义:一个化学反应不管是一步完成,还是分为数步完成,其热效应总是相同的。
化学反应热效应:当体系发生反应之后,使产物的温度回到反应前始态时的温度,体系放出或吸收的热量,称为该反应的热效应。
意义:热化学反应方程式可以像代数式一样计算
推论:正逆反应的热效应数值相等,符号相反
盖斯定律是一切热力学的基础。在日常生活中,也经常用到,只是没有用理论去总结概括它。
先看一个例题:

焓变随化学反应的加减而改变
因为反应(3)的产物不固定(在氧不充足的情况下,反应生成物有二氧化碳,也有一氧化碳),所以无法通过实验室测定其焓变,但可以根据已知反应的焓变求得。
4.1.6.2物质的标准态
讨论物质的性质,必需先确定物质所在的状态(P、V、T和聚集形态),状态不确定的情况下,物质的性质无法确定
国家标准GB3100~3102—93规定:
标准状态没有规定温度,一般默认为298.15K(25℃).
化学反应的标准态:反应物与生成物都处于标准状态
备注:测定一个反应的恒压热效应,虽然反应过程可能因为放热或者吸热会有温度和压强变化,但因为温度、压强等都是状态函数,与途径的过程无关,只要始态和终态的温度和压强相同,测出来的就是化学反应的焓变。
4.1.6.3标准摩尔生成焓
标准摩尔生成焓:在标准状态下,在反应进行的温度,由指定的单质在标准状态下生成1mol物质的焓变,称为该物质的标准摩尔生成焓,用下述符号表示:
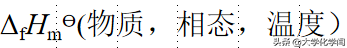
f代表formation
这个符号里,Δ是变化量,f是生成,H是焓,m是每摩尔,ϴ是标准态。然后要备注上物质的名字、相态/形态、温度。有时候同素异形体也要加以区别,比如不能说碳的标准摩尔生成焓,而要说金刚石或者石墨的标准摩尔生成焓。
如果无特殊说明,温度默认是298.15K
指定的单质一般是最稳定的单质,磷元素的除外(指定白磷,最稳定是红磷)
推论:指定单质的标准摩尔生成焓是0(一定要是指定单质)
水溶液中,水合离子标准摩尔生成焓:物质B生成1mol水合离子的标准摩尔焓变,氢离子的被定义是0,其他的与氢离子相比较得到.
4.1.6.4标准摩尔焓变

公式的推导是盖斯定律的应用
常见物质的标准摩尔生成焓可以通过查表查到,所以大部分化学反应标准摩尔焓变可以直接通过公式求得。
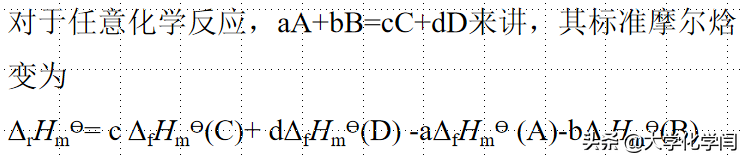
化学计量数一定不要漏掉呀
并且一般认为焓变不随温度变化而改变,虽然我们查表查到的都是298.15K时的标准摩尔焓变,等也可以用到其他温度(严格意义上讲:不同温度的焓变并不一样,但其差别一般不大于5%,在工科化学里可以忽略这种差别)。

标准摩尔焓变通常忽略温度的影响
标准摩尔焓变的数值与化学方程式写法密切相关,和物质形态也密切相关。
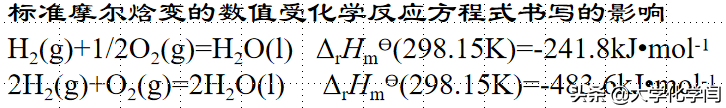
可以看成化学方程式(2)是2个化学方程式(1)相加而得到的,也是盖斯定律的应用之一
下面,我们看个计算标准摩尔焓变的例题:

铝热反应的标准摩尔焓变
每摩尔氧化铝的焓比起每摩尔氧化铁的焓少了851.5KJ,这部分多出来的焓就以反应热的形式释放了出来。
思考题:在计算公式里,我们为什么没有把单质铝和单质铁的标准摩尔生成焓写进去
标准摩尔焓变可以在生物学或工程学里来计算热值:

燃料燃烧会释放能量,所以热值通常是负数